Nagendran Balasundrama,b ,Kalyana Sundram b, Samir Samman a,*aHuman Nutrition Unit, School of Molecular and Microbial Biosciences, University of Sydney, G08, Sydney 2006, NSW, Australia bMalaysian Palm Oil Board (MPOB), No. 6 Persiaran
Institusi, Bandar Baru Bangi, 43000 Kajang, Malaysia 上海梵蓝 关静姝译
植物多酚是植物中磷酸戊糖、莽草酸盐和苯丙酸途径的次生代谢产物(Randhir,Lin,& Shetty,2004)。植物多酚是植物中最广泛存在的一类化合物,具有重要的生理和形态意义。其在植物生长和繁殖中发挥重要作用,提供保护、抵御病原体和捕食者(Bravo, 1998),此外还影响水果和蔬菜的颜色和感官特征(Alasalvar,Grigor,Zhang,Quantick,& Shahidi,2001)。
植物多酚具有广泛的生理特性,如抗过敏、抗动脉硬化、抗炎、抗微生物、抗氧化、抗血栓、心脏保护和血管舒张作用(Benavente-Garcia,Castillo,Marin,Ortuno,Del Rio,1997;Manach,Mazur,& Scalbert,2005;Middleton,Kandaswami,& Theoharides,2000;Puupponen-Pimia et al.,2001;Samman,Lyons Wall,Cook,1998)。
摄入大量水果和蔬菜所带来的健康益处与植物多酚有关(Hertog,Feskens,Hollman,Katan,& Kromhout,1993;Parr & Bolwell,2000)。植物多酚的有益作用是其抗氧化活性(Heim,Tagliaferro,Bobilya,2002)。植物多酚可能是食物抗氧化能力的主要决定因素(Parr & Bolwell,2000),因此可能是抗氧化剂的天然来源。本文综述了植物多酚的抗氧化活性、植物多酚的生物利用度和代谢等方面的研究进展,并探讨其作为食品抗氧化剂的应用前景。
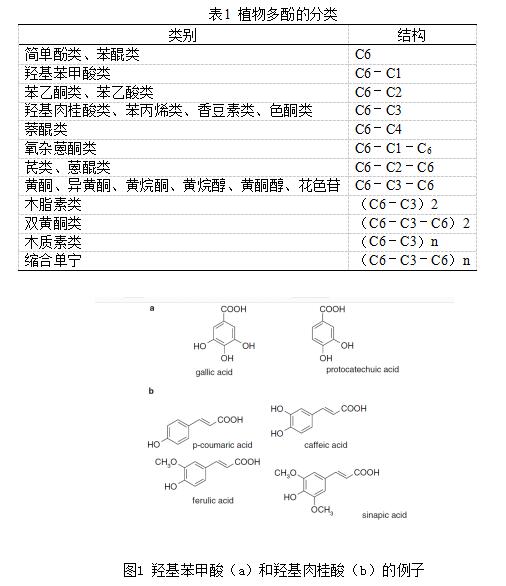
1 植物多酚的化学特性 从结构上看,植物多酚包括一个芳香环,含有一个或多个羟基取代基,从简单的酚类分子到高度聚合的化合物(Bravo,1998)。尽管存在结构上的多样性,但这类化合物统称为多酚。大多数天然存在的酚类化合物以单糖和多糖的形式存在,与一个或多个酚基相连,也可能以功能衍生物如酯和甲酯的形式出现, (Harborne,1989;Harborne,Baxter,& Moss,1999;Shahidi &Naczk,1995)。虽然结构多样性使自然界中酚类化合物广泛存在,但酚类化合物基本上可以分为几个类别,如表1所示(Harborne,1989;Harborne
et al.,1999)。其中,酚酸、黄酮类化合物和单宁是主要的膳食酚类化合物(King & Young,1999)。酚酸由两种组成,即羟基苯甲酸和羟基肉桂酸(图1)。羟基苯甲酸包括没食子酸、对羟基苯甲酸、原儿茶酸、香草酸和丁香酸,它们都具有C6-C1结构。另一方面,羟基肉桂酸是三碳侧链(C6-C3)的芳香化合物,以咖啡酸、阿魏酸、对香豆素酸和芥子酸最为常见(Bravo,1998)。
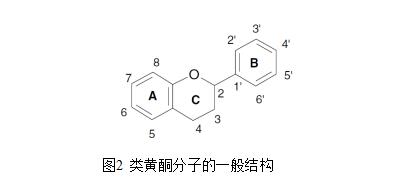
黄酮类化合物是最大的一类植物多酚,占8000多种天然酚类化合物的一半以上(Harborne et al.,1999)。黄酮类是一种低分子量化合物,由15个碳原子组成,呈C6-C3-C6结构。该结构由两个芳香环A和B组成,由一个3碳桥连接,通常以杂环C的形式存在(图2)。芳香环A来源于乙酸/丙二酸途径,而环B来源于苯丙氨酸通过莽草酸途径(Bohm,1998;Merken & Beecher,2000)。环C的替代模式变化导致了主要的类黄酮分类,即黄酮醇、黄酮酮、黄烷醇(或儿茶素)、异黄酮、黄烷醇、花青素(图3)。环A和环B的取代导致了类黄酮类的不同化合物(Pietta,2000)。这些替代可能包括氧合、烷基化、糖基化、酰化和硫酸化(Bohm,1998;Hollman
& Katan,1999)。
单宁是相对高分子量,构成第三类重要酚类的化合物,可分为水解单宁和缩合单宁(Porter,1989)。前者是没食子酸酯(没食子单宁和鞣花单宁),后者(也称为原花青素)是多羟基黄烷-3-醇单体的聚合物(Porter,1989)。第三种,完全由间苯三酚组成,已经从几个褐藻属中分离出来(Porter,1989),但这些在人类饮食中并不显著(Bravo,1998)。
2 结构与活性关系 植物多酚的抗氧化活性取决于它们清除自由基、提供氢原子或电子或螯合金属阳离子的能力(Afanas_ev,Dorozhko,Brodskii,Kostyuk,& Potapovitch,1989;Amarowicz,Pegg,Rahimi-Moghaddam,Barl,& Weil,2004)。植物多酚的结构是其清除自由基和金属螯合活性的关键决定因素,称为结构-活性关系(构效关系)。以酚酸为例,其抗氧化活性取决于羟基与羧基官能团之间的数量和位置(Rice-Evans,Miller,&
Paganga,1996;Robards,Prenzler,Tucker,Swatsitang,& Glover,1999)。酚酸的抗氧化活性随着羟基数量增加而增加,三羟基没食子酸即是如此表现出较高的抗氧化活性。然而,在3位和5位的羟基被甲氧基取代,会降低活性,如丁香酸中的甲氧基(Rice-Evans et al.,1996)。
与羟基苯甲酸相比,羟基肉桂酸具有更高的抗氧化活性(Andreasen,Landbo,Christensen,Hansen,&Meyer,2001a)。羟基肉桂酸的高活性可能是由于CH=CH -COOH基团,这个基团比羟基苯甲酸的-COOH基团具有更强的供氢能力和稳定性(Rice-Evans et al.,1996)。
由于类黄酮分子的相对复杂性,类黄酮的构效关系比羟基苯甲酸和羟基肉桂酸要复杂得多。B、C环上取代物的结构特征和性质决定了类黄酮抗氧化活性,如下:
(i)B环羟基化的程度和羟基的位置,特别是B环的邻二羟基结构(邻苯二酚基团)有更高的活性,因为它通过电子移位比芳氧基具有更高的稳定性(van Acker et al.,1996),或作为微量金属的首选结合位点(Pietta,2000)。
(ii)与单一羟基相比较,在B环3'-,4'-和 5'-位置上羟基的存在(连苯三酚结构)增强了类黄酮的抗氧化活性(van Acker et al.,1996)。而某些情况下,这种化合物可以作为促氧化剂,从而抵消了抗氧化作用(van Acker
et al.,1996)。这与Seeram和Nair(2002)报道一致,转换3',4'-两羟基苯基转化成3',4',5'-三羟基苯基增加花青素的抗氧化活性,但减少了儿茶素的活性。
(iii)C环上的C-2和C-3之间的双键与环上的4-氧代基团结合,增强了黄酮类化合物的自由基清除能力(Pietta,000)。
(iv)在环C中,C-2和C-3之间的双键结合3-OH,也增强了类黄酮清除自由基的活性,如山奈酚(van Acker et al.,1996)。取代3-OH会导致扭转角的增加和共面性的丧失,从而降低抗氧化活性(Seeram & Nair,2002)。
(v)B环中甲氧基取代的羟基会改变氧化还原电位,从而影响黄酮类化合物清除自由基的能力(Pietta,2000;Seeram & Nair,2002)。
3 植物多酚的生物利用和代谢 植物多酚的健康益处取决于它们的吸收和代谢(Parr & Bolwell,2000),而这些益处又取决于它们的结构,包括它们与其他酚类化合物的结合、酯化/酰化程度、分子大小和溶解度(Bravo,1998)。最初人们认为肠道中没有糖苷裂解酶,意味着只有糖苷元可以通过细胞膜(Kuhnau,1976)。然而,Hollman,de Vries,van Leeuven,Mengelers和Katan (1995)对健康回肠造口志愿者的研究发现,在人体内确实存在糖苷的吸收。有研究表明,槲皮素苷的生物利用度取决于附着在酚结构上的糖基,例如,与葡萄糖结合可以提高生物利用度(Hollman
& Katan,1999)。植物多酚的生物利用度也会受到细胞壁结构、细胞内糖苷位置和食物基质中酚类化合物结合的差异的影响(Hollman et al.,1997)。
早期对植物多酚生物利用度的研究大多集中在最常见的膳食类黄酮醇、槲皮素。然而,近年来在了解大多数其他类酚类化合物的吸收和代谢方面取得了重大进展。这些研究主要集中在花青素、黄酮、儿茶素、原花青素、羟基苯甲酸和羟基肉桂酸,并已被Manach,Williamson,Morand,Scalbert,& Remesy(2005)和Williamson,Manach(2005)阐述。
胃肠道吸收一些酚苷的确切机制尚未被完全阐明,但乳糖酶的参与根皮甙水解酶(LPH),活性糖转运蛋白(SGIT1),载体-中介运输过程和多重耐药相关蛋白(MRP)的可能作用已经被假定(Clifford,2004;Hollman et al.,1997;Murota & Terao,2003;Yang,Landau,Huang,& Newmark,2001)。Andreasen,Kroon, Williamson和Garcia-Conesa (2001b)的研究表明,由肠道酯酶释放的谷类植物芽孢中发现的酯化异环酸盐可以穿过胃肠道屏障进入外周循环。据估计,小肠吸收的植物多酚约占总摄入量的5-10%。小肠未吸收的植物多酚在肝脏吸收和代谢并随胆汁排泄的化合物进入结肠(Scalbert
& Williamson,2000;Yang et al.,2001)。结肠菌群分泌的酶水解未吸收的糖苷,剥离其连接的分子的共轭,将较大的酚类化合物分解成简单的分子,如酚酸,或分裂杂环含氧环(Hollman,2001;Scalbert & Williamson,2000)。
植物多酚可能在小肠、肝脏或肾脏中经历甲基化(由儿茶酚- O -甲基转移酶催化,COMT)、硫酸化(由硫转移酶催化,SULT)或葡萄糖醛酸化(由UDP葡萄糖醛酸转移酶催化,UGT),或上述过程的组合(Yang et al.,2001)。代谢的主要部位依赖于剂量,小剂量在肠粘膜中代谢,肝脏起次要作用,大剂量在肝脏中代谢(Scalbert & Williamson,2000)。这些酶的生物转化通常导致羟基的结合,产生降低抗氧化活性的代谢物(Hollman,2001;Manach,Scalbert,Morand,Remesy,&
Jimenez,2004)。
植物多酚的一个主要关注点是其具有抗营养物质的作用,特别是它们能够通过直接沉淀或抑制酶活性来降低蛋白质的消化率(Ferguson,2001)。例如,单宁与饮食中的蛋白质和碳水化合物以及酶形成复合物(Naczk,Oickle,Pink,& Shahidi,1996;Naurato,Wong,Lu,Wroblewski,& Bennick,1999)。此外,单宁酸也被证明可以减少铁和铜等矿物质的吸收(Reddy & Cook,1991;Samman et al.,2001)。然而,这些金属的螯合有时可能是有益的,因为这是酚类化合物发挥其抗氧化活性的机制之一(Bravo,1998)。
由于这方面研究还很有限,人们对过度食用植物多酚可能产生的副作用表示了担忧。Mennen,Walker,Bennetau-Pelissero和 Scalbert(2005)综述了几项研究表明,某些酚类化合物在高浓度下可能具有致癌性、基因毒性、甲状腺毒性、与药物的相互作用和雌激素活性(对于异黄酮)。
植物多酚在植物中普遍存在,当人们食用植物性食物时,植物多酚有助于人类饮食中天然抗氧化剂的摄入。农工副产品是酚类化合物的良好来源,已被开发为天然抗氧化剂的来源。虽然使用天然的酚类化合物作为食品抗氧化剂受到关注,但实际生产需要考虑多方面,包括提取效率、充足的可利用的原料、毒性或安全方面的考虑。为了获得最佳的抗氧化效率,必须解决这些副产物中酚类化合物的复杂性。