作者:谢 强,林玉桓,苗淑萍,李 晶,夏秀华
摘 要: 研究香芹酚对革兰氏阴性菌大肠杆菌( ATCC 8735) 和革兰氏阳性菌金黄色葡萄球菌( ATCC 3101) 的形态、细胞膜的完整性与通透性的影响。结果表明: 与对照组相比,经香芹酚处理后的样品组具有较高的紫外吸光值、电导率值和酶活力。随着香芹酚作用时间的延长,实验组的紫外吸光值、电导率值和酶活性均有快速的增加,并达到一个相对稳定的状态。同时,扫描和透射电镜图显示,经香芹酚作用 6~8h 后,大肠杆菌和金黄色葡萄球菌的形态均有明显改变。香芹酚在最低抑菌浓度(
MIC 0.31mg/mL) 作用于大肠杆菌和金黄色葡萄球菌,能够破坏菌体细胞膜和细胞壁的完整性、并引起细胞膜通透性和菌体形态的改变。
关键词: 香芹酚,细菌细胞膜,完整性,通透性,形态结构
香芹酚( 2-甲基-5-异丙基苯酚) ,是牛至和百里香等植物精油的主要成分[1] 。近年来,香芹酚的菌活性受到了极大的关注[2-6] ,并在美国和欧洲被批准为安全食品添加剂[7-8] 。研究发现,香芹酚对细菌、酵母菌、真菌、昆虫及螨类均具有良好的生长抑制作用[9-12] 。本课题前期的研究发现,香芹酚对大肠杆菌和金黄色葡萄球菌的 MIC ( 最低抑菌浓度) 均为0.31mg/mL[13] 。然而,香芹酚的抑菌活性机理尚且缺乏系统研究[2] 。有研究认为 [14] ,作用于细胞膜可能是单萜类化合物、苯丙烯和相关含氧化合物发挥抑菌作用的重要机制,因为微生物的脂质成分在环境中化学物理特性发生改变的情况下会发生较大的变异[15-16]
,而在应对外部干扰时,细胞膜脂质的变异又对维持细胞膜的流动性、完整性和功能性有着重要作用[17] 。所以,微生物脂质成分的变化可能导致细胞膜物理特性的变化,并可能在影响细胞膜的渗透性方面发挥重要作用[18] 。因此,本实验旨在研究香芹酚对大肠杆菌和金黄色葡萄球菌细胞膜的影响。通过检测香芹酚处理后菌悬液的紫外吸收和电导率研究香芹酚对细菌细胞膜完整性的影响; 结合检测β-半乳糖苷酶活力探讨香芹酚对细菌细胞膜通透性的影响; 并采用扫描电镜和透射电镜技术观察香芹酚对细菌形态的影响。
1 材料与方法
1.1 材料与仪器
香芹酚( 98% ) 、邻硝基苯-β-D-吡喃半乳糖苷( ONPG) Sigma-Aldrich 公司; 大肠杆菌、金黄色葡55萄球菌 吉林大学人兽共患病研究所。
UV-2550 紫外可见分光光度计 日本岛津公司; DDSJ-308A 电导率仪 上海雷磁仪器厂有限公司; ES-2030 真空冷冻干燥机、E-1010离子溅射仪、S-3400N扫描电子显微镜、H-7650 透射电子显微镜 日本日立公司。
1.2 实验方法
1.2.1 菌悬液紫外吸收的测定
在 Cooper 等[19] 实验方法的基础上,实验操作如下: 取对数生长期大肠杆菌或金黄色葡萄球菌菌液,5000r/min 离心 10min,收集菌体,用磷酸盐缓冲溶液( PBS,pH 7.4) 洗涤三次后重新悬浮,使菌悬液 A 630nm = 0.5 ± 0.02。根据之前的研究结果,香芹酚对大肠杆菌和金黄色葡萄球菌的 MIC 均为 0.31mg/mL [13] ,设计三个香芹酚浓度梯度。用香芹酚溶液与稀释好的菌液按照不同体积混合,使香芹酚最终浓度分别为
MIC( 0.31mg/mL) 、2MIC( 0.63mg/mL) 和 4MIC( 1.25mg/mL) ,然后放置于( 37 ±1) ℃摇床中分别培养 0、1、2、4、6 和 8h。将样品经 0.22μm 滤膜过滤,滤液用紫外分光光度计于260nm 处测定吸光值(A260nm) ,以不加香芹酚的菌悬液为空白对照,每个样品重复三次。
1.2.2 菌悬液电导率的测定
根据 Lee 等[20-21] 的实验方法,利用电导率仪对培养液中电解质的检测,可以用来探究细胞内容物的外溢情况。取对数生长期大肠杆菌或金黄色葡萄球菌菌悬液,5000r/min
离心10min,收集菌体,用 0.85% NaCl 洗涤三次后重新悬浮,使菌悬液 A 630nm = 0.5 ± 0.02,之后,加入香芹酚及进行培养的操作与紫外吸收测定部分一致。各时间点取 5mL 菌液,10000r/min 离心 15min,取上清液测定菌悬液电导率。以不加香芹酚的菌悬液作为空白对照,每个样品重复三次。
1.2.3 菌悬液中 β-半乳糖苷酶活力的测定
通过以 ONPG 为底物对大肠杆菌或金黄色葡萄球菌菌悬液中 β-半乳糖苷酶活性的测定,可以探究细胞膜的通透性[22-23]
。取对数生长期大肠杆菌或金黄色葡萄球菌 菌 悬 液,5000r/min 离 心 10min,收 集 菌 体,0.05mol/L NaH 2 PO 4 磷酸缓冲液洗涤三次重新悬浮,使菌悬液 A 600nm 约为 0.2。之后加入香芹酚及进行培养的操作与紫外吸收测定部分一致。各时间点立取10mL,10000r/min 离 心 15min,离 心 后 取 上 清 1mL,加 入 4mL 0.05mol/L ONPG,37℃ 水 浴 反 应40min,然后加入 0.5mol/L Na 2 CO 3 5mL
终止反应,420nm 下 比 色。实 验 重 复 三 次。酶 活 力 计 算 公式为:
β-半乳糖苷酶活力单位( U/mL) = ( OD 420 × A) /( B × C ×0.0045)
其中: A 是反应混合液体积( mL) ,5mL; B 是反应时间( min) ,40min; C 是样品体积( mL) ,10mL;0.0045( mL/n mol) 是消光系数。
所以:β-半乳糖苷酶活力单位( U/mL) = OD 420 ×2.7781.2.4 扫描电镜观察 取对数生长期的菌体,用多聚赖氨酸包被 10h,再用 MIC 的香芹酚作用 6~8h,PBS 洗涤 3 次后,用 2.5% 的戊二醛于 4℃ 固定 2h。
PBS 缓冲液洗涤 3 次,每次
15min,之后用锇酸于 4℃固定 30min。样品经乙醇脱水,再用真空冷冻干燥机进行干燥,经离子溅射仪进行离子喷金后,最后通过扫描电子显微镜观察。以未经香芹酚处理的菌体作为空白对照,实验重复三次。
1.2.5 透射电镜观察
对数期生长的大肠杆菌和金黄色葡萄球菌菌悬液,于浓度为 MIC 的香芹酚作用6~8h。8000r/min 4℃离心 15min,并用 PBS 洗涤 2~3次,收集菌体,用 4% 的戊二醛于 4℃ 固定 24h,PBS洗涤 3 次,每次 15~45min。样品经梯度脱水、包埋剂包埋
3h、超薄切片和醋酸双氧铀与柠檬酸铅分别染色 10min,最后进行透射电镜观察。以未经香芹酚处理的菌体作为空白对照,实验重复三次。
2 结果与讨论
2.1 香芹酚对细菌细胞膜完整性的影响
细胞内容物是否外溢是细胞膜是否完整的标志。当细胞膜遭到破坏时,胞内的一些磷酸盐、碳酸盐、DNA 与 RNA 等均会先后从细胞膜中释放出来,而这些核内物质在 260nm 处有很强的紫外吸收[25] ,同时,菌悬液中电解质增加,其电导率也会增加。因此,可以通过检测菌悬液的紫外吸收和电导率的变化情况来推测菌体细胞膜完整性的变化。
2.1.1 紫外吸收测定
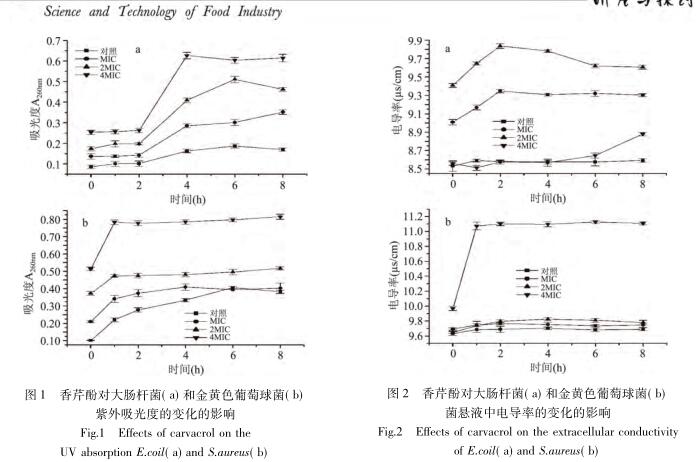
香芹酚对大肠杆菌和金黄色葡萄球菌作用后的菌悬液紫外吸光值(
以下用 A 260nm代替) 随时间的变化情况见图 1。结果表明,随着时间的延长,经香芹酚作用后的两种菌悬液的 A 260nm 变化均为先快速增长后达到相对稳定状态。然而,可能由于革兰氏阳性菌的金黄色葡萄球菌没有细菌外膜[19] 的原因,大肠杆菌和金黄色葡萄球菌的结果存在一些差异。如图1a 所示,对大肠杆菌而言,香芹酚作用的实验组的 A 260nm 在 2~4h 有明显的增长,MIC、2MIC 和 4MIC 的香芹酚剂量组在 4h 的 A 260nm 分别为0.286 ±0.0089,0.409
± 0.0113 和 0.627 ± 0.0162,均明显高于空白对照组 0.163 ± 0.0087。与大肠杆菌不同的是,香芹酚作用下的金黄色葡萄球菌菌悬液的 A 260从初始时间就快速增长并于 1h 后达到平稳期( 图1b) 。对照组及 MIC、2MIC、4MIC 的香芹酚剂量组在1h 的 A 260 分别为 0.221 ± 0.0121,0.342 ± 0.0235,0.474±0.0089,0.783 ±0.0132。
由图 1 可以看出,香芹酚浓度不同,菌悬液起始的紫外吸收值不同,可能是由于香芹酚浓度不同,引起的吸收不同所致,且两种菌菌悬液的紫外吸收值随着香芹酚浓度的增加而增加。此外,与大肠杆菌不同的是,金黄色葡萄球菌对照组的紫外吸收值随着时间的延长有缓慢的增加,同时,MIC、2MIC 香芹酚作用的金黄色葡萄球菌剂量组相比于对照组的变化没有 4MIC 香芹酚剂量组明显,这可能与金黄色葡萄球菌对香芹酚的药敏性有关。
Chen 和 Cooper [19] 研究表明,钾离子的外溢与菌体的生长抑制有关,无机磷酸盐和
260nm 吸光物的释放与抑菌剂的杀菌活性有关。此结果中,两种菌菌悬液的紫外吸收值随着香芹酚浓度的增加而增加,这说明,香芹酚的浓度越高,相同时间与条件下菌悬液中紫外物质积累越多,香芹酚对细菌细胞膜的完整性破坏越严重。
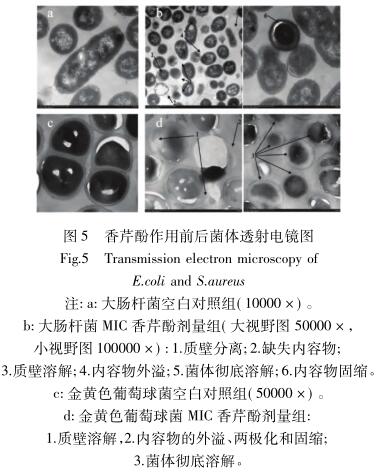
2.1.2 电导率测定
浓度为 MIC、2MIC 和 4MIC 的香芹酚作用于大肠杆菌和金黄色葡萄球菌后,菌悬液的电导率变化见图 2。对于大肠杆菌( 图 2a) ,在浓度为 MIC 和 2MIC 的香芹酚作用下,菌悬液的电导率不仅高于对照组而且在 0~2h 内有明显增加,同时2MIC 香芹酚剂量组的电导率值高于 MIC 香芹酚剂量组,MIC 和 2MIC 香芹酚剂量组在 2h 的电导率值分别为 9.347 ± 0.0196、9.837 ± 0.0258μs/cm。然而,4MIC
香芹酚剂量组的大肠杆菌菌悬液的电导率随着时间延长增长趋势较缓慢,这可能是由于前面提到的离心分离步骤中菌体外溢物对沉淀物有吸附的原因,致使在电导率测定前外溢物被离心分离掉。对于金黄色葡萄球菌( 图 2b) ,在浓度为 4MIC 的香芹酚作用下,菌悬液的电导率明显高于对照组,且在0~1h 内有明显增加,在 1h 的电导率值为 11.074 ±0.0518μs/cm,之后电导率也趋于稳定状态。与紫外吸光度实验结果想似的是,MIC、2MIC 香芹酚作用的金黄色葡萄球菌剂量组相比于对照组的变化同样没有4MIC
香芹酚剂量组明显,原因同紫外吸收部分。
综上可以发现,经香芹酚处理后,菌悬液中紫外吸收和电导率均有不同程度增加。可见香芹酚对两种菌体细胞膜的完整性产生了不同程度的影响。且在同样的作用时间和条件下,一定浓度范围内,香芹酚的浓度越大,影响越明显。
2.2 香芹酚对细菌细胞膜通透性的影响
β-半乳糖苷酶、乳酸脱氢酶、碱性磷酸酶等均属于膜内物质,正常情况下不会分泌到细胞外,但当细胞膜受到破坏时,胞内部分酶会泄漏到细胞外。因此,菌液中 β-半乳糖苷酶的酶活性可以作为表征细胞膜通透性是否发生变化的一个参数[25]。
在 2h,经浓度为 MIC、2MIC 和 4MIC 的香芹酚作用后,大肠杆菌菌悬中 β-半乳糖苷酶的酶活力分别为0.558 ± 0.0042、0.575 ± 0.0051、0.614 ± 0.0068U/mL,明显高于对照组( 0.419 ± 0.0031)
U/mL; 金黄色葡萄球菌菌悬液中 β-半乳糖苷酶的酶活力分别为 0.528 ±0.0058,0.544 ± 0.0055、0.542 ± 0.0064U/mL,同样明显高于对照组( 0.264 ±0.0025) U/mL。
大肠杆菌和金黄色葡萄球菌菌悬液的 β-半乳糖苷酶的酶活力变化存在一些差异。从图3a 可以看出,大肠杆菌菌悬液的酶活力在 0~1h 快速增加,在1~2h增长速度相对缓慢; 而从图 3b 来看,金黄色葡萄球菌菌悬液的酶活力在1~2h 快速增加,却在0~1h相对缓慢。这可能仍与两种菌的结构不同有关。
以上结果表明,菌体经香芹酚作用后,随着时间的增加,菌悬液中 β-半乳糖苷酶的酶活力增加。可以推断,细胞内 β-半乳糖苷酶逐渐从胞内流出,香芹酚影响了细菌细胞膜的通透性。
2.3 香芹酚对细菌微观形态影响
2.3.1 扫描电镜下细菌的形态分析
香芹酚加入前后菌体的扫描电镜结果如图 4 所示。对照组中( 图4a 和图 4c) ,大肠杆菌和金黄色葡萄球菌均呈具有光滑 细 胞 膜 的 正 常 形 态。然 而,经浓 度 为 MIC( 0.31mg/mL) 的香芹酚作用后,两种菌在形态上发生了较大的改变。大肠杆菌主要表现为附有颗粒的粗糙细胞膜、伴有黏性物质的粘连状态和几乎溶解的菌体; 金黄色葡萄球菌主要表现为具有大量黏膜的粘连状态和褶皱的细胞膜。

由结果可知,相对于金黄色葡萄球菌,香芹酚对大肠杆菌的形态有着更大的影响。Eaton 等认为[26] ,作为革兰氏阴性菌的大肠杆菌具有外膜而且生物膜很可能是香芹酚的作用目标,所以此结果可以算是在意料之中; Ceylan 等也曾报道[27-29] ,革兰氏阴性菌对植物精油的耐药性要强于革兰氏阳性菌,Storia 认为[3] ,细胞表面结构的改变是菌体对外界压力的适应性反应的表现,即作为革兰氏阴性菌的大肠杆菌因为耐药性强所以才表面形态改变较大。
此外,在香芹酚作用下,大肠杆菌的细胞膜变得粗糙且具有颗粒物,由此推测,香芹酚可能使更多的成分暴露于外膜(
如蛋白质和脂质) ,从而导致表面粗糙度增加; 而金黄色葡萄球菌则表现为细胞膜更加的褶皱,以此可以假设,香芹酚穿过了肽聚糖然后作用在细胞质膜,Storia 等认为[3] ,金黄色葡萄球菌细胞质膜结构的改变,如流动性,可能只是引起细胞膜表面微小的变化。
Moosavy 等认为[30] ,严重的形态损伤和膜破坏会增加菌体对细胞内容物的通透性。所以,此处香芹酚对大肠杆菌和金黄色葡萄球菌菌体形态的影响的结果与紫外吸收测定、电导率测定及 β-半乳糖苷酶活性测定的结果均是一致的。
2.3.2 透射电镜下细菌的形态分析
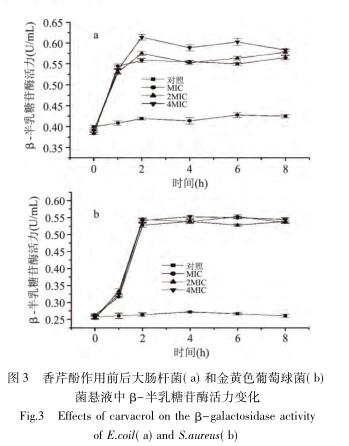
香芹酚加入前后大肠杆菌和金黄色葡萄球菌的透射电镜结构如图5 所示。与对照组相比( 图 5a 和 5c) ,香芹酚作用的菌体均形态异常( 图 5b 和 5d) 。最突出的表现有细胞壁和细胞膜的溶解、细胞内容物的外溢以及由于异常蛋白沉淀而出现的内容物固缩[31] 。此外,大肠杆菌中还出现了质壁分离与缺失内容物的空腔现象; 金黄色葡萄球菌中还出现了细胞内容物的极化现象。电镜结果可知,香芹酚可能作用于菌体的不同部分,所以香芹酚的抑菌作用机制可能存在不同的作用方式。
3 结论
本研究结果表明,香芹酚在最低抑菌浓度( MIC0.31mg/mL) 作用于大肠杆菌和金黄色葡萄球菌,能够破坏菌体细胞膜和细胞壁的完整性、并引起细胞膜通透性和菌体形态的改变。由此推测,香芹酚的抑菌机制可能与它的理化特性相关。香芹酚可能作用于细胞膜,导致细胞膜特性的改变,以此影响整个菌体生长; 也可能进一步穿过细胞膜,进入细胞内部并与细胞内的抑菌活性位点作用,以此抑制菌体活性。对于香芹酚如何进入菌体细胞内,如何与菌体发生作用,以及其遗传大分子的影响有待更多的基础研究。