热门关键词: 抗菌消炎饲料添加剂供应 梵蓝饲用精油 饲料植物精油哪家好 植物单宁酸价格
单宁酸的抗菌活性早已得到公认,单宁酸对细菌、真菌和酵母的毒性也有综述(Scalbert. 1991)。到目前为止单宁酸抗菌活性机制包括抑制胞外微生物酶,剥夺微生物生长所需的基质,通过氧化磷酸化抑制微生物代谢,剥夺金属离子或与引起细胞壁形态变化和膜透性增加的细菌形成细胞膜复合物(Scalbert, 1991; Liu et al., 2013) 。证据表明微生物细胞膜是单宁酸抑制作用的主要场所(Mcallister et al., 2005;Liu et al.,2013),通过细胞聚合和细胞膜的破坏和功能(图 2)。虽然蛋白质沉淀是所有单宁酸的普遍特性,但是单宁酸的抗菌活性是微生物种特异性的,与单宁酸的化学组成和结构密切相关。一般来说,单宁酸对革兰氏阳性菌的抗菌活性大于对革兰氏阴性菌的抗菌活性(Ikigai et al., 1993; Smith andMackie, 2004),因为革兰氏阴性细菌的外膜是由脂质双层结构组成,脂质双层结构由外膜的脂多糖和蛋白质组成,内层由磷脂组成。然而,从几种植物中分离到的单宁酸,尤其是 CT单宁酸对革兰氏阴性菌具有较强的抗菌活性。值得注意的是,大肠杆菌0157:H7、沙门氏菌、志贺氏杆菌、葡萄球菌、假单胞菌、幽门螺杆菌等病原菌均对单宁酸敏感(Funatogawa et al. ,2004: Doss et al.,2009;Banso and Adeyemo, 2010;Liu etal.,2013) 。Wang等(2013)比较12种单宁酸,发现仅从紫色草原三叶草中分离的 CT(Dalea purpurea Vent)和褐藻(Ascophylhum nodosum)中分离的PT具有较强的抗大肠杆菌和抗大肠杆菌 0157:H7活性。褐藻多酚的抗菌活性也高于CT和HT (Wang et al., 2009)。已有研究表明,单宁酸氧化过程中羟基的数量和过氧化氢的释放是影响单宁酸抗菌性能的两个重要因素(Akagawa et al.,2003: Smith et al.2003:Mueller-Harvey, 2006) 。有研究表明,具有三羟基B环的黄酮醇(没食子儿茶素) 对链球菌、梭菌、变形杆菌和葡萄球菌的抑制作用大于具有二羟基B环的儿茶素(Sakanaka等, 1985)。同样,表儿茶素没食子酸和表没食子儿茶素酸对肉毒杆菌的毒性也大于它们的非没食子对应物表儿茶素和表没食子儿茶素(Okuda et al.,1985) 。由于单宁酸的来源广泛其抗菌活性具有很大的多样性,因此筛选和鉴定对目标微生物有效且特异的单宁酸将是一项连续不断的研究工作。
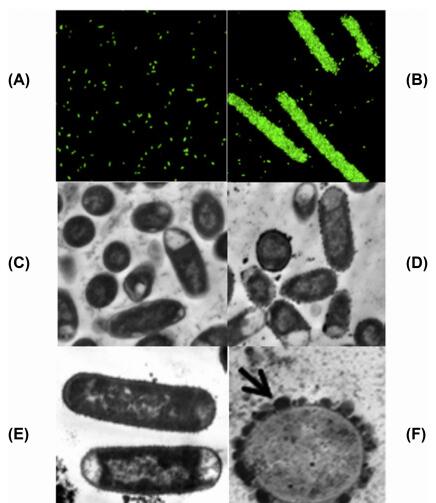
透射电子显微图,引自 Wang et al.(2009, 2013) 和Liu et al. (2013)
(A) 大肠杆菌(25922 株) 细胞培养10 h( 对照组) 、(B) 200 ug /ml 紫色牧场三叶草的浓缩单宁酸
(C) 大肠杆菌(3081 株) 孵化24 h( 对照组) 、(D) 50 ug / mL 酚类单宁酸
(E)50 ug / mL 可水解单宁酸、(F) 50 ug / mL浓缩单宁酸
单宁酸在反刍动物生产中最成功的应用可能是减少胃胀气。胃胀气是反刍动物的一种常见消化障碍。胃胀气的特征是气体在瘤胃和网胃内积聚,这会损害消化和呼吸功能 (Wang et al.. 2012)。胃胀气的原因很多,但植物细胞进入瘤胃后迅速溶解并释放蛋白质,增加瘤胃液粘度是导致胃胀气的主要因素。单宁酸通过在咀嚼和反刍过程中沉淀蛋白质而降低蛋白质在瘤胃中的溶解度,从而减少胀气的发生。因此,含单宁酸的饲料被认为是“无胀气”的。Li等(1996)估计只需1.0 mg CT/g DM就可以防止胀气。在紫花苜蓿中添加红豆素等含CT的饲料是控制胀气的有效方法(Fig. 3; Wang et al., 2006; Sottie etal., 2014)。
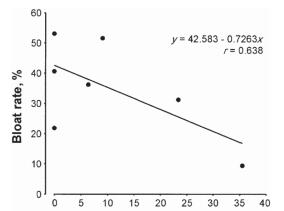
测定肉牛采食牧草后胃气胀比率与牧草中红豆草含量的回归分析,(n = 12)
单宁酸在反刍动物,特别是放牧反刍动物中的另一个主要应用是控制消化道寄生虫。Hoste等(2006)在体内研究表明在红豆仁、苏拉、胡枝子、牛蒡、菊苣中的单宁酸对绵羊、山羊和鹿的消化道有显著的杀虫作用。来自含羞草(HT),板栗(HT) 和白坚木 (CT) 的外源性单宁酸以及用于控制反刍动物肠道中的各种寄生虫 (Butter et al., 2001 ;Min and Hart,2003;Min et al.,2005, 2015)。日粮中单宁酸的浓度低于20 g/kg DM不能有效控制反刍动物肠道内寄生虫。一个有趣的现象是绵羊可以检测到体内寄生虫或相关症状,并增加对富含单宁酸的饲料的偏好(Lisonbee
et al.,2009;Juhnke et al.,2012)。
最近,将含单宁酸的饲料添加到日粮中作为减少反刍动物消化道食源性致病菌的一种方法,已被研究(表1)。紫色草原三叶草已被证明是一种潜在的可以减轻大肠杆菌0157:H7的饲料,大肠杆菌0157:H7这是一种存在于反刍动物消化道的致命的食物致病菌(lin et al., 2015: Huang et al.,2015)。Huang等人(2015)研究发现给羔羊喂食含有36 g紫色紫色草原三叶草CT/kg DM其大肠杆菌0157:H7含量显著低于不喂食CT的羔羊。同样CT(16-20
g CT/kg DM)也被证明可以减少天然牧场粪便中的大肠杆菌(Jin et al., 2015)。此外,在饲喂干草饲料的牛日粮中添加浓度为15 g/kg DM的板栗单宁酸可以减少粪便中的大肠杆菌(Min et al., 2007)。然而来源于红豆素和胡枝子的单宁酸在较低浓度(<13.5 g CT/kg DM)时对粪便中的大肠杆菌没有影响(Lee et al., 2009a,b; Berard et al.,2009)。在日粮添加10~ 20g/kg DM A. nodosum可显著减少牛粪便中的大肠杆菌0157:H7(表1)。在这些研究中没有报道单宁酸浓度,但
A. nodosum是含有高水平PT的褐藻 (Wang and McAllister, 2011)。
这些研究表明饲喂植物单宁酸是一种切实可行的方法,可有效减少反刍动物消化道中大肠杆菌0157:H7的存在,从而降低动物体污染的风险,提高食品安全。
表1 日粮中单宁酸对反刍动物粪便中大肠杆菌和大肠杆菌0157:H7 的影响
|
来源 |
单宁酸类型 |
动物 |
日粮 |
添加量 |
可见效果 |
参考文献 |
|
褐藻萃取物 |
Phlorotannins(PT) |
饲养场牛 |
谷物基础日粮 |
0, 10 or 20 g/kg日粮,14d屠宰前 |
减少粪便和隐藏的大肠杆菌和大肠杆菌O157:H7 |
Behrends etal. (2000) |
|
褐藻 |
(PT) |
牛 |
谷物基础日粮 |
20 g/kg干物质 |
减少粪便和隐藏的大肠杆菌O157:H7和沙门氏菌 |
Barham et al. (2001) |
|
褐藻 |
(PT) |
饲养场牛 |
玉米基础日粮 |
20 g/kg日粮, 14d屠宰前 |
减少标本和粪便中的大肠杆菌O157:H7 |
Braden et al. (2004) |
|
褐藻 |
(PT) |
受大肠杆菌O157:H7攻毒的牛 |
大麦基础精料 |
10g/kg或20 g/kg日粮,直到14d |
减少粪便中的大肠杆菌O157:H7 |
Bach et al. (2008) |
|
紫色牧场三叶草 |
浓缩单宁酸(CT)
|
大肠杆菌O157:H7攻毒的羔羊 |
新鲜牧草 |
36 g/kgDM ECT |
减少粪便中的大肠杆菌O157:H7 |
Huang et al. (2015) |
|
胡枝子 |
(CT) |
山羊 |
干草 |
13.5 g/kg DM ECT |
对粪便中的大肠杆菌无影响 |
Lee et al. (2009a,b) |
|
板栗 |
水解单宁酸(HT) |
牛 |
干草 |
15 g/d
|
减少粪便中的大肠杆菌 |
Min et al. (2007) |
|
红豆草 |
(CT) |
牛 |
干草/青贮饲料 |
1.1~12 g/kg DM
|
对粪便无影响 |
Berard et al. (2009) |
|
紫色牧场三叶草 |
(CT) |
牛 |
新鲜牧草 |
16~20 g/kg DM ECT
|
减少粪便中的大肠杆菌 |
Jin et al. (2015) |
ECT :萃取浓缩单宁酸
5. 单宁酸在单胃动物中的应用
与反刍动物不同,单宁酸在传统上被认为是单胃动物营养中的“抗营养”因子,对采食量、营养物质消化率和生产性能有负面影响(Butler, 1992; Redondo et al., 2014)。因此,尽量减少含单宁酸的饲料在猪和家禽饲料中的使用或采取措施降低其膳食浓度,这是饲料工业的一种常见做法。然而,最近的一些报道表明一些低浓度的单宁酸改善了单胃动物的健康状况、营养和动物性能(Schiavone et al., 2008; Zotte andCossu, 2009;
Biagia et al., 2010; Brus et al., 2013; Starčević et al., 2015)。与反刍动物相比,单宁酸促进单胃动物生长的作用机制要少得多。虽然有报道表明,低浓度的单宁酸增加了单胃动物的采食量,从而提高了单胃动物的性能,但鉴于单宁酸具有涩味,这似乎不是通过提高饲料的适口性来实现的。目前的资料表明,单宁酸在单胃动物中生长促进作用依赖于平衡它们的正负面影响,负面影响是通过蛋白质和酶消化络合对饲料的适口性的影响,正面影响是它们通过抗菌,抗氧化和抗炎活动促进肠道生态的健康状况的影响。单宁酸对动物性能的影响最终取决于动物的种类和它们的生理状态、饲料、单宁酸的种类以及它们在日粮中的浓度。与其他家畜相比,猪似乎对单宁酸有相对的抵抗力,它们能够采食相对富含单宁酸的饲料而不会出现任何中毒症状(Pinna
et al. 2007)。这可能是由于腮腺肥大和唾液中分泌的富含脯氨酸的蛋白质结合和中和单宁酸的毒性作用(Cappai et al.,2010, 2014)。与用于反刍动物的单宁酸的巨大来源相比,用于单胃动物的单宁酸的来源相当有限,到目前为止只有很少的单宁酸被研究并作为饲料添加剂(表2)。
表2 单宁酸在单胃动物中的应用
|
来源 |
单宁酸类型 |
动物 |
添加量 |
作用 |
参考文献 |
|
板栗 |
HT |
生长猪 |
0.15%HT+0.15% 4种酸的混合物 |
对健康状况或生长性能无影响 |
Stukelj et al. (2010) |
|
板栗 |
HT |
猪 (22~127 kg) |
0.19%HT+0.16% 5种酸 |
提高生长性能;增加乳酸菌;降低肠道中的大肠杆菌 |
Brus et al. (2013) |
|
板栗 |
HT |
猪 (11~50 kg) |
0.71%, 1.5% |
对采食量、体增重和胴体特性无影响;饲料转化率降低;唾液腺和尿道腺体尺寸减小 |
Bee et al. (2016) |
|
板栗 |
HT |
猪 (8.2~20 kg) |
0.11%, 0.23%, 0.45% |
提高饲料转化率;减少盲肠中氨、异丁酸和异戊酸的浓度;对盲肠细菌数量无影响;空肠乳酸菌数量有增加趋势 |
Biagia et al. (2010) |
|
板栗 |
HT |
猪(6周) |
0.3% |
对粪便中沙门氏菌无影响;对肠道及肠道组织的定植无影响 |
Parys et al. (2010) |
|
板栗 |
HT |
猪 |
1%, 2%, 3% |
增加小肠绒毛高度,以及绒毛周边和黏膜的厚度;减少大肠有丝分裂和细胞凋亡;对肝脏无影响 |
Bilic-sobot et al. (2016) |
|
板栗 |
HT |
肉鸡 |
0.15%~1.2% |
减少肠道中的产气芽胞杆菌(艾美耳球虫) |
Tosi et al. (2013) |
|
板栗 |
HT |
肉鸡 |
0.15, 0.20, 0.25% |
0.2%单宁酸提高生长性能;对氮平衡和胴体特性无影响 |
Schiavone et al. (2008) |
|
板栗 |
HT |
蛋鸡(50周) |
0.20% |
对蛋重、细胞厚度和蛋黄颜色无影响;胆固醇含量降低;单不饱和脂肪酸增加 |
Antongiovanni et al. (2015) |
|
葡萄籽 |
浓缩单宁酸(CT)和其他酚类化合物 |
猪 (130~150 kg) |
1% |
增加粪便微生物毛螺菌、梭菌、乳酸菌以及瘤胃菌的丰富度 |
Choy et al. (2014) |
|
葡萄籽提取物 |
CT和其他酚类化合物 |
肉鸡 |
0.72% |
体增重降低,乳酸菌和肠球菌增加,回肠内容物中梭状芽胞杆菌数量减少;盲肠内容物中的大肠杆菌、乳酸杆菌、肠球菌以及梭状芽胞杆菌数量增加 |
Viveros et al. (2011) |
|
葡萄籽提取物 |
CT |
柔嫩艾美耳球虫攻毒的肉鸡 |
5, 10, 20, 40, 80 mg/Kg日粮 |
柔嫩艾美耳球虫感染的肉鸡死亡率降低,体增重增加,且呈剂量依赖性,10 ~ 20 mg/kg效果最好;感染肉鸡的生长性能和抗氧化状态增加 |
Wang et al. (2008) |
表2 (续)
|
来源 |
单宁酸类型 |
动物 |
添加量 |
作用 |
参考文献 |
|
葡萄籽提取物 |
CT |
肉鸡(0~42d) |
125, 250, 500, 1,000, 2,000 mg/kg |
对生长性能、死亡率、总脂、高低密度脂蛋白无影响;总胆固醇和低密度脂蛋白降低;对新城疫的抗体效价提高 |
Farahat et al. (2017) |
|
葡萄籽提取物 |
CT |
肉鸡(21d) |
0.025,0.25,2.5,5.0g/kg |
添加5.0g/kg降低生长性能,回肠对蛋白质和氨基酸的消化率明显降低;血浆中铜铁锌浓度线性下降;日粮中添加2.5 g/kg葡萄籽提取物对鸡的生长性能、蛋白质和氨基酸的消化率无不良影响 |
Chamorro et al. (2013) |
|
布拉酵母菌发酵的葡萄渣 |
CT |
猪(19 kg) |
0.30% |
添加30g/kg可改善生长性能、营养物质消化率,改变皮下脂肪及部分猪的脂肪酸特性 |
Yan and Kim (2011) |
|
葡萄渣 |
CT和其他酚类化合物 |
猪 |
2.80% |
减少胃肠道对霉菌毒素的吸收;马来西亚的白葡萄渣效果优于红葡萄渣 |
Gambacorta et al. (2016) |
|
葡萄渣 |
CT |
猪 |
10% |
不影响硫代巴比妥酸反应产物的产生;增加猪肉的红度 |
Bertol et al. (2017) |
|
葡萄渣 |
CT和其他酚类化合物 |
肉鸡 |
6% |
对生长性能无影响;乳酸菌和肠球菌增加;回肠内容物中的梭菌数量减少;盲肠内容物中大肠杆菌、乳酸菌、肠球菌和梭菌数量增加 |
Viveros et al. (2011) |
|
葡萄渣 |
CT和其他酚类化合物 |
肉鸡(1~21d) |
5%, 10% |
对生长性能无影响;增加氧化稳定性和多不饱和脂肪酸 |
Chamorro et al. (2015) |
|
葡萄渣 |
CT和其他酚类化合物 |
肉鸡(21~42d) |
1.5%, 3%, 6% (0.22%, 0.45% ,0.9% CT) |
对生长性能、消化器官大小、蛋白质消化率无影响;日粮、排泄物、回肠内容物以及胸部肌肉的抗氧化活性增加 |
Brenes et al. (2008) |
|
单宁酸 |
HT |
猪 |
125, 250, 500, 1,000 mg/kg |
总的平均日增重、饲料效率和粪便大肠菌群计数呈线性下降 |
Lee et al. (2010) |
|
单宁酸 |
HT |
猪 |
125 mg/kg |
对生长性能无影响;当日粮中铁含量不足时,对血液学和血浆铁含量有负面影响;总厌氧菌、梭状芽孢杆菌和大肠杆菌数量减少,双歧杆菌和乳酸菌数量增加 |
Lee et al. (2009a,b) |
表2 (续)
|
来源 |
单宁酸类型 |
动物 |
添加量 |
作用 |
参考文献 |
|
单宁酸 |
HT |
肉鸡(1~35d) |
0.50% |
生长性能增加;血糖水平降低;胸部和大腿部脂肪含量增加;肝脏胆固醇含量降低 |
Starcevic et al. (2015) |
|
单宁酸 |
HT |
肉鸡(1~12d) |
0, 0.75%,1.5% |
对培养阳性的雏鸡盲肠沙门氏菌和盲肠内容物中鼠伤寒沙门氏菌无影响 |
Kubena et al. (2001) |
|
单宁酸 |
HT |
肉鸡 |
2.5%, 3% |
体增重、蛋白利用率、法氏囊重、胸腺和脾脏重量降低;免疫球蛋白IgM、IgG水平、总白细胞数和绝对淋巴细胞减少 |
Marzo et al. (1990) |
|
单宁酸 |
HT |
肉鸡 |
1% |
体增重和采食量降低;,通过减少单不饱和脂肪酸,改善热应激下肉鸡胸肌脂肪的分布 |
Ebrahim et al. (2015) |
|
甜板栗 |
HT |
肉鸡(1~42d) |
0.025%, 0.05%, 0.1% |
添加0.025%和0.05%对生长性能和饲料转化率无影响;添加0.1%生长性能降低;对胴体品质无影响;小肠中的大肠杆菌和大肠杆菌菌群减少 |
Jamroz et al. (2009) |
|
甜板栗 |
HT |
鸡 (21, 23 d) |
0.07%, 0.2% (0.05%, 0.15%HT) |
对生长性能无影响;对有机物、粗蛋白、钙磷利用率无影响;粪便中干物质含量增加 |
Rezar and Salobir (2014) |
|
含羞草 |
CT |
肉鸡(1~22d) |
0.5%, 1.5%, 2.0%, 2.5% |
采食量和体增重降低; 添加量低于1.5%的饲料利用率有所改善;能量、蛋白和氨基酸在回肠的消化率降低;对胰腺和空肠酶类的活性无影响 |
Iji et al. (2004) |
|
红色白坚木 |
CT |
攻毒过的肉鸡 |
10% |
攻毒过的肉鸡体增重增加;绒隐比增加;卵囊排出量减少 |
Cejas et al. (2011) |
|
橡子 |
HT |
猪(14~28 kg) |
0.516单宁酸当量/kg |
对采食量无影响;饲料转化率提高;对胃黏膜无影响 |
Cappai et al. (2013) |
5.1 板栗单宁酸
来源于板栗的可水解单宁酸最近被认为是单胃动物饲料添加剂。虽然体外研究表明它对动物消化道寄生虫和病原体有很强的抑制作用(Chung et al., 1998; Athanasiadou etal., 2000; Butter et al., 2001),但体内评估对动物性能的结果并不一致。在猪日粮中添加0.11%-0.45%板栗HT,发现HT提高饲料效率倾向于增加空肠中乳酸杆菌数量和减少盲肠中氨,异丁酸,异戊酸的浓度,但是对盲肠中细菌数量,粪便中沙门氏菌数量没有影响(Biagia
et al.. 2010; Parys et al.,2010)。然而将浓度从0.71%提高到1.5%会降低饲料效率,但不影响采食量增长和胴体重量(Bee et al., 2016)。Stukeli等(2010)报道,0.15%的板栗HT与0.15%的酸的混合物对猪的健康状况或生长性能没有影响,而Brus等(2013)研究发现0.19%的板栗HT与0.16%的酸混合使肠道中的乳酸菌增加,大肠杆菌数量减少。
Schiavone等(2008)研究了添加0.15%、0.20%和0.25%的板栗单宁酸产品(77.8%
HT)对肉鸡生长性能的影响。结果表明,添加0.20%的板栗单宁酸可提高日采食量和平均日增重。但是当添加0.25%时,由于所有的测量参数都是最低的,似乎会产生负面影响。Jamroz等(2009)研究了日粮中添加0.025%、0.05%和0.1%的甜栗单宁酸对鸡的性能、肠道微生物菌群和肠道组织学特征的影响。结果表明,添加单宁酸对饲料转化率和胴体质量无影响,但添加0.1%单宁酸,末体重下降,母细胞增殖速度减慢。添加0.05%~0.1%单宁酸,28日龄鸡小肠大肠杆菌和大肠杆菌菌群减少。在另一项研究中,Rezar和Salobir(2014)研究发现,添加0.07%和0.2%的相同单宁酸产品(0.05%和0.1%
HT)对肉鸡生长性能或有机质、粗蛋白、粗灰分、钙磷平衡和利用没有影响,但粪便中干物质含量增加。在一项有挑战的研究中,Tosi等(2013)报道,日粮中添加0.71%和1.5%的板栗HT可降低口服这些球虫的肉鸡肠道中的产气荚膜梭菌(柔嫩艾美耳球虫,锥形艾美耳球虫,巨型艾美耳球虫)。
添加0.45%和0.5%板栗HT可增加兔子活体重增加和采食量(Maertens and štruklec, 2006;Zoccarato et al., 2008)。然而,Liu等(2009)研究发现添加0.5%和1.0%的板栗HT对兔子的生长性能没有影响。以上信息表明,根据不同动物和日粮类型的不同,在猪和兔子的日粮中添加量低于0.5%板栗HT和在鸡的日粮中添加量低于0.2%的板栗HT,对其生长性能和肠道健康会有积极的影响。日粮中添加高剂量的板栗HT(高于上述提及到的高剂量),很可能会通过降低营养物质的消化吸收导致动物生长性能降低(li
et al.. 2004: Ebadi et al., 2005;Mansoori, 2009; Mansoori et al., 2015)。
5.2 葡萄单宁酸
葡萄籽和葡萄果渣提取物(酿酒葡萄)中含有大量的多酚类化合物,包括CT (Prieur et al., 1994; Choy et al.,2014),已被评估作为天然饲料添加剂用于单胃动物生产中。Choy等(2014)研究发现在猪日粮中添加1%的葡萄籽提取物可增加粪便微生物菌群中毛螺菌、Clostridales、乳酸菌和瘤胃菌的数量。他们发现葡萄单宁酸中的低聚物(二聚-五聚物)只有部分被肠道微生物代谢,产生的酚类代谢产物更容易被吸收。这些酚类化合物可能有助于改变菌群数量,从而对结肠产生有益的作用。Wang等(2008)研究发现,用柔嫩艾美耳球虫感染肉鸡,在其日粮中添加5
~ 80 mg/kg葡萄籽提取物CT显著减少了粪便中柔嫩艾美耳球虫,改善了抗氧化状态,降低死亡率和生长性能的增加,其最有利的结果是添加10~20 mg CT/kg干物质。Farahat等(2017)研究表明在肉鸡日粮中添加0.125%~2%葡萄籽提取物具有显著的抗氧化和免疫刺激剂作用,添加0.125%~0.25%的剂量最佳。进一步增加浓度会对禽类的生长性能、蛋白质和氨基酸的消化产生负面影响(Chamorro et al.,2013)。葡萄渣是葡萄加工的副产品,包括果皮、果肉等,含有大量的CT和简单酚类化合物。几项评价葡萄渣对猪和家禽性能影响的研究表明,日粮中添加10%富含单宁酸的产品,对肉鸡的生长性能没有影响,但增强了抗氧化状态,增加了肠道中有益菌的数量
(Brenes et al., 2008; Viveros etal., 2011; Chamorro et al., 2015)。Yan和Kim(2011)的研究表明,在猪的日粮中添加0.3%的使用布拉酵母菌发酵的葡萄渣,可以改善猪的生长性能、营养物质的消化率,改变皮下脂肪中的脂肪酸模式以及猪肉的一些特性。葡萄渣还能提高猪肉的抗氧化活性,降低猪对霉菌毒素在胃肠道的吸收。然而,葡萄渣的这些影响可能并不完全归因于CT,因为其他酚类化合物也存在于产品中。
5.3 单宁酸
单宁酸是一种HT,来自不同的植物,包括塔拉豆荚(Caesalpinia spinosa),五倍子(Rhus semialat)没食子或西西里漆树叶 (Rhus coriaria)。Lee等(2010)研究表明,日粮添加0.0125% ~ 0.1%的单宁酸对猪的生长性能、血液指标和血浆状态有负面影响,粪便大肠菌数量呈线性下降。然而,同样的作者研究发现,当添加0.0125%的单宁酸时,对猪的生长性能没有影响,但对血液学和血浆铁状态有负面影响。添加0.0125%的单宁酸使总厌氧菌、梭状芽胞杆菌和大肠杆菌数量减少,双歧杆菌和乳酸菌数量增加(Lee
et al., 2009a,b)。在肉鸡日粮中添加0.5%单宁酸,肉鸡的生长性能提高,胸部肌肉和大腿肌肉的脂肪含量增加,但血糖浓度和肝脏中胆固醇的含量降低(Starčevićet al ., 2015)。也有报道称,日粮中添加0.75%和1.5%的单宁酸不会改变盲肠沙门氏菌呈阳性的肉鸡,也不会改变肉鸡盲肠中鼠伤寒沙门氏菌的数量(Kubena t al., 2001)。添加2.5%和3.0%单宁酸会降低生长鸡的体增重和蛋白质效率,并通过减少法氏囊、胸腺和脾脏的重量损伤免疫功能,减少总免疫球蛋白M
(1 g)和免疫球蛋白G的水平,减少总白细胞和淋巴细胞,且呈剂量依赖性(Marzo et al ., 1990)。Ebrahim等(2015)发现添加1%的单宁酸降低肉鸡体增重和采食量,在热应激条件下,通过减少单不饱和脂肪酸,改善了肉鸡胸部肌肉的脂肪酸分布。从以上结果可以看出,单宁酸在猪和家禽中的应用均高于其他来源的单宁酸,但对动物的性能产生积极影响的报道较少,虽然在一些研究中报道了抗氧化能力提高。高剂量的(如21%)似乎会降低动物的生产效率。
5.4 其他来源的单宁酸
有些研究评估了其他来源的单宁酸用于单胃动物。Iji等(2004)研究表明在肉鸡日粮中添加0.5%、1.5%、2.0%、2.5%含羞草单宁酸提取物(CT),采食量和体增重降低,但在低于1.5%的水平上可以提高饲料效率。在禽类日粮中添加单宁酸降低了回肠对能量、蛋白质和氨基酸的消化能力,但对胰腺和空肠酶的活性无明显影响。Cappai等(2014)研究发现日粮中添加橡子HT,0.516单宁酸当量/kg日粮,HT对采食量和胃粘膜无影响,但提高了日粮的效率。本研究评估了红色坚木CT对减少柔嫩艾美耳球虫攻毒肉鸡球虫病的影响(Cejas
et al., 2011)。研究表明,添加10%CT提取物可使受试鸡体重增加,增加肠绒毛比例,减少卵囊排泄。本研究表明,红色坚木CT可能是一种潜在的预防抗球虫产品。Zotte和Cossu(2009)研究发现在为期6周的饲养试验中,1%和3%的红坚木单宁酸显著改善了兔子的体增重和饲料转化率。
6 单宁酸作为家畜饲料中抗生素的替代品的挑战
上述信息清楚地表明,虽然植物单宁酸在体外具有较强的抗菌和抗寄生虫作用,但在体内观察到的效果差异很大。许多因素,包括由于植物来源、生长条件、加工方法以及使用方法和饲养条件的不同,使得产品的化学组成有变化,从而导致这种巨大的多样性。由于这些问题的复杂性,很难对这些化合物的有效性和安全性进行系统和全面的评估,这无疑阻碍了单宁酸和单宁酸产品用于畜牧业作为一种可行的抗菌促生长剂的应用。因此,控制这种变化是开发单宁酸产品作为天然抗菌饲料添加剂的关键。这可能包括从生产到应用的所有程序。
药用植物和草药长期使用而不引起耐药性的原因之一可能是配方中含有的多种化合物或复合处方具有协同作用。在复杂而动态的混合物中,单个化合物之间的这种协同作用使微生物难以适应多种化合物。然而,在长期使用分离的单一植物性抗菌化合物时可能不会出现这种情况,这可能导致某些微生物产生耐药性。抗疟化合物青蒿素就是一个很好的例子,它存在于传统中药青蒿(青蒿,菊科)中。青蒿作为一种草药,在中医历史上一直被用来有效治疗疟疾(Miller and Su. 2011)。然而经过几十年的使用,纯化的青蒿素对疟疾的有效性降低,表明微生物对这种化合物产生了某种程度的耐药性。这一趋势与细菌抗生素耐药性的发展趋势相似。这表明,在动物饲料中长期使用纯化的植物化合物作为抗微生物生长促进剂有产生耐药性的风险。目前用于动物工业的单宁酸主要是不同分子大小的混合物的粗提物或含有一系列次生化合物的整株植物。再加上来自不同来源和生长条件的化合物的化学成分和结构的变化,将降低微生物对复杂单宁酸形成耐药性的可能性。然而在这方面的研究很少,管理机构、科学界和生产工业需要共同努力,防止微生物对单宁酸和其他对人类健康重要的植物次生化合物形成耐药性,因为这将对人类产生巨大的影响。